(a) Pada kesetimbangan, ada lebih banyak produk daripada reaktan, dan kesetimbangan dikatakan berada di sebelah kanan.
(b) Dalam situasi sebaliknya, ketika ada lebih banyak reaktan daripada produk, kesetimbangan dikatakan berada di sebelah kiri.
Konsep konstanta kesetimbangan sangat penting dalam kimia. Seperti yang Anda mau segera lihat, konstanta kesetimbangan adalah kunci untuk memecahkan berbagai stoikiometri masalah yang melibatkan sistem ekuilibrium. Sebagai contoh, seorang ahli kimia industri yang ingin memaksimalkan hasil asam sulfat, katakanlah, harus memiliki pemahaman yang jelas konstanta kesetimbangan untuk semua langkah dalam proses, dimulai dari oksidasi sulfur dan diakhiri dengan pembentukan produk akhir. Seorang dokter yang mengkhususkan diri dalam kasus klinis ketidakseimbangan asam-basa perlu mengetahui konstanta kesetimbangan asam dan basa lemah. Dan pengetahuan tentang konstanta kesetimbangan dari gasphase yang bersangkutan reaksi akan membantu ahli kimia atmosfer lebih memahami proses perusakan ozon di stratosfer. Untuk menggunakan konstanta kesetimbangan, kita harus mengekspresikannya dalam bentuk reaktan dan konsentrasi produk. Satu-satunya panduan kami adalah hukum aksi massa [Persamaan (14.2)], yang merupakan rumus umum untuk menemukan konsentrasi kesetimbangan. Namun, karena konsentrasi reaktan dan produk dapat diekspresikan dalam unit yang berbeda dan karena spesies yang bereaksi tidak selalu dalam fase yang sama, mungkin ada lebih dari salah satu cara untuk menyatakan konstanta kesetimbangan untuk reaksi yang sama. Untuk mulai dengan, kami akan mempertimbangkan reaksi di mana reaktan dan produk berada dalam fase yang sama.
Kesetimbangan homogen
Istilah keseimbangan homogen berlaku untuk reaksi di mana semua spesies bereaksi berada di fase yang sama. Contoh keseimbangan gas-fasa homogen adalah disosiasi N2O4. Konstanta kesetimbangan, sebagaimana diberikan dalam Persamaan (14.1), adalah
Perhatikan bahwa subskrip di Kc menunjukkan bahwa konsentrasi spesies yang bereaksi dinyatakan dalam molaritas atau mol per liter. Konsentrasi reaktan dan produk dalam reaksi gas juga dapat dinyatakan dalam tekanan parsial mereka. Dari Persamaan (5.8) kita melihat bahwa pada suhu konstan tekanan P suatu gas adalah berhubungan langsung dengan konsentrasi dalam mol / L gas; yaitu, P = (n / V) RT. Demikian,untuk fase processe keseimbangan. Contoh keseimbangan gas-fasa homogen adalah disosiasi N2O4. Konstanta kesetimbangan, sebagaimana diberikan dalam Persamaan (14.1), adalah
N2O4 (g) → 2NO2 (g)
Kita dapat tulis:
di mana PNO2 dan PN2O4 adalah tekanan parsial kesetimbangan (dalam atm) NO2 dan N2O4, masing-masing. Subscript di Kp memberitahu kita bahwa konsentrasi kesetimbangan diekspresikan dalam hal tekanan. Secara umum, Kc tidak sama dengan Kp, karena tekanan parsial reaktan dan produk tidak sama dengan konsentrasi mereka dinyatakan dalam mol per liter. Sederhana hubungan antara KPp dan Kc dapat diturunkan sebagai berikut. Mari kita pertimbangkan yang berikut ini ekuilibrium dalam fase gas:
aA(g) ↔ bB(g)
di mana a dan b adalah koefisien stoikiometri. Konstanta kesetimbangan Kc diberikan oleh
dan ekspresi untuk Kp
di mana PA dan PB adalah tekanan parsial A dan B. Dengan asumsi perilaku gas ideal:
dimana V adalah volume wadah dalam liter. Juga
Mensubstitusikan hubungan-hubungan ini ke dalam ekspresi untuk Kp, kita dapatkan
Sekarang baik nA / V dan nB / V memiliki satuan mol / L dan dapat digantikan oleh [A] dan [B], maka:
Dimana:
∆n = b – a
mol produk gas - mol reaktan gas
Karena tekanan biasanya dinyatakan dalam atm, konstanta gas R diberikan oleh 0,0821 L. atm / K. mol, dan kita bisa menulis hubungan antara KP dan Kc sebagai
Secara umum, Kp = Kc kecuali dalam kasus khusus di mana ∆n = 0 seperti dalam kesetimbangan campuran molekul hidrogen, molekul bromin, dan hidrogen bromida:
H2 (g) + Br2 (g) ↔ 2HBr (g)
Dalam hal ini, Persamaan (14.5) dapat ditulis sebagai
Kp = Kc (0,0821 T)0
= Kc
Sebagai contoh lain dari ekuilibrium homogen, mari kita pertimbangkan ionisasi asam asetat (CH3COOH) dalam air:
CH3COOH(aq) + H2O ↔ CH3COO-(aq) + H3O+(aq)
Konstanta kesetimbangan adalah
(Kami menggunakan Kc primer untuk di sini untuk membedakannya dari bentuk final dari konstanta kesetimbangan untuk diturunkan di bawah ini.) Dalam 1 L, atau 1000 g, pada air, ada 1000 g / (18,02 g / mol), atau 55,5 mol, air. Oleh karena itu, "konsentrasi" air, atau [H2O], adalah 55,5 mol / L, atau 55,5 M. Ini adalah jumlah yang besar dibandingkan dengan konsentrasi spesies lain di Indonesia solusi (biasanya 1 M atau lebih kecil), dan kita dapat berasumsi bahwa itu tidak berubah lumayan selama reaksi. Dengan demikian, kita dapat memperlakukan [H2O] sebagai konstanta dan menulis ulang konstanta kesetimbangan sebagai
Dimana
Kc = Kc’[H2O]
Konstan dan Satuan Ekuilibrium
Perhatikan bahwa itu adalah praktik umum untuk tidak memasukkan unit untuk konstanta kesetimbangan. Di Termodinamika, konstanta kesetimbangan didefinisikan dalam hal aktivitas daripada konsentrasi. Untuk sistem yang ideal, aktivitas suatu zat adalah perbandingannya konsentrasi (atau tekanan parsial) ke nilai standar, yaitu 1 M (atau 1 atm). Ini prosedur menghilangkan semua unit tetapi tidak mengubah bagian-bagian numerik dari konsentrasi atau tekanan. Akibatnya, K tidak memiliki unit. Kami akan memperluas praktik ini ke asam basa kesetimbangan keseimbangan dan kelarutan dalam Bab 15 dan 16.
Contoh 14.1 hingga 14.3 mengilustrasikan prosedur penulisan konstanta kesetimbangan ekspresi dan menghitung konstanta kesetimbangan dan konsentrasi kesetimbangan.
Tuliskan ekspresi untuk Kc, dan KP jika berlaku, untuk reaksi reversibel berikut pada keseimbangan:
(a) HF(aq) + H2O(l) ↔ H3O+ (aq) + F-(aq)
(b) 2NO(g) + O2 ↔ 2NO2 (g)
(c) CH3COOH (aq) + C2H5OH(aq) ↔ CH3COOC2H5 (aq) + H2O(l)
Strategi Ingatlah fakta-fakta berikut: (1) Ekspresi KP hanya berlaku untuk reaksi gas dan (2) konsentrasi pelarut (biasanya air) tidak muncul ekspresi konstanta kesetimbangan.
Solusi (a) Karena tidak ada gas, KP tidak berlaku dan kami hanya memiliki Kc.

HF adalah asam lemah, sehingga jumlah air yang dikonsumsi dalam ionisasi asam dapat diabaikan dibandingkan dengan jumlah total air yang ada sebagai pelarut. Jadi, kita bisa tulis ulang konstanta kesetimbangan sebagai (b) 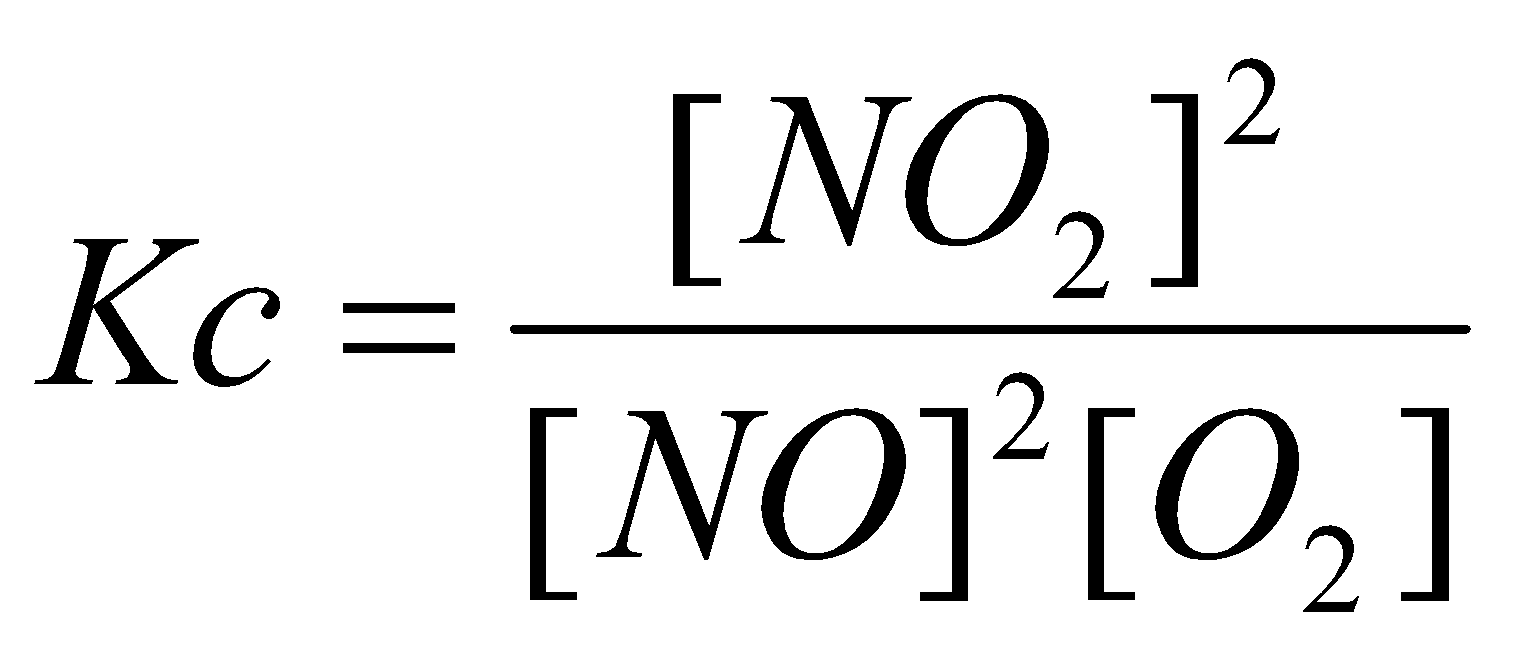

(c) Konstanta kesetimbangan K’c diberikan oleh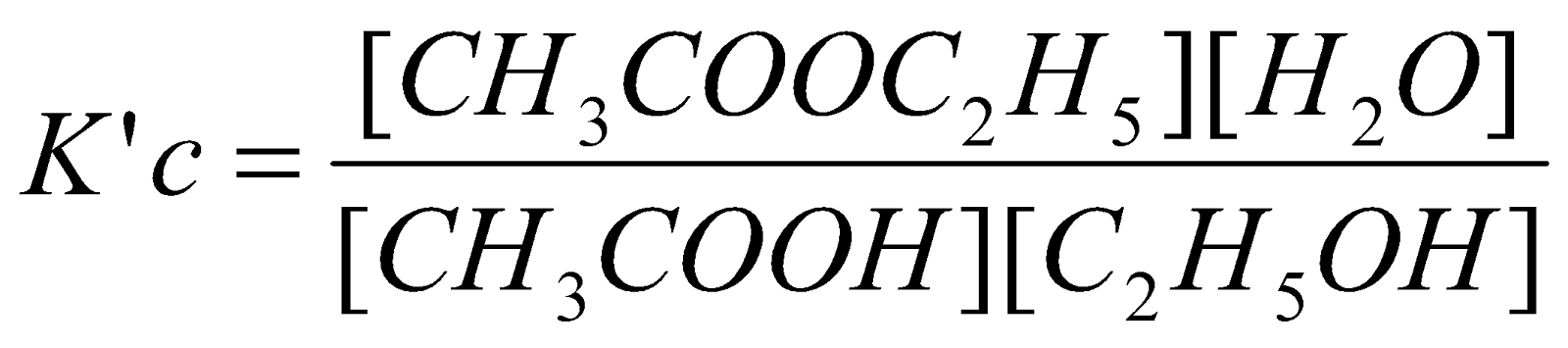
Latihan Praktik Tulis Kc dan KP untuk dekomposisi pentoksida nitrogen: 2N2O5 (g) ↔ 4NO2(g) + O2 (g)
Contoh 14.2
Proses ekuilibrium berikut telah dipelajari pada 230 ° C:
2NO(g) + O2(g) ↔ 2NO2 (g)
Dalam satu percobaan, konsentrasi spesies yang bereaksi pada kesetimbangan ditemukan jadilah [NO] = 0,0542 M, [O2] = 0,127 M, dan [NO2] = 15,5 M. Hitung kesetimbangan konstan (Kc) dari reaksi pada suhu ini.
Strategi Konsentrasi yang diberikan adalah konsentrasi kesetimbangan. Mereka memiliki unit mol / L, sehingga kita dapat menghitung konstanta kesetimbangan (Kc) menggunakan hukum aksi massa [Persamaan (14.2)].
Solusi Konstanta kesetimbangan diberikan oleh
Mengganti konsentrasi, kami menemukannya
Periksa Perhatikan bahwa Kc diberikan tanpa unit. Juga, besarnya Kc adalah konsisten dengan konsentrasi produk tinggi (NO2) relatif terhadap konsentrasi reaktan (NO dan O2).
Latihan
Carbonyl chloride (COCl2), juga disebut phosgene, digunakan di Dunia Perang I sebagai gas beracun. Konsentrasi kesetimbangan untuk reaksi antara karbon monoksida dan klorin molekul untuk membentuk karbonil klorida.
CO(g) + Cl2 (g) ↔ COCl2 (g)
pada 74°C adalah [CO] = 1,2 x 10-2 M, [Cl2] = 0,054 M, dan [COCl2] = 0,14 M. Hitung konstanta kesetimbangan (Kc).
Contoh 14.3
Konstanta kesetimbangan Kp untuk dekomposisi fosfor pentaklorida menjadi fosfor triklorida dan klorin molekuler
PCl5 (g) ↔ PCl3 (g) + Cl2 (g)
ditemukan menjadi 1,05 pada 250 ° C. Jika tekanan parsial ekuilibrium PCl5 dan PCl3 adalah 0,875 atm dan 0,463 atm, masing-masing, berapa tekanan parsial kesetimbangan Cl2 pada 250 °C?
Strategi Konsentrasi gas-gas yang bereaksi diberikan dalam atm, sehingga kita dapat mengekspresikannya konstanta kesetimbangan di Kp. Dari nilai Kp yang diketahui dan tekanan kesetimbangan PCl3 dan PCl5, bisa kita pecahkan untuk PCl2.
Solusi Pertama, kami menulis KP dalam hal tekanan parsial dari spesies yang bereaksi
Mengetahui tekanan parsial, kami menulis
Periksa Catatan bahwa kami telah menambahkan atm sebagai unit untuk PCl2.
Latihan Praktik Konstanta kesetimbangan Kp untuk reaksi
2NO2(g) ↔ 2NO(g) + O2 (g)
adalah 158 pada 1000 K. Hitung PO2 jika PNO2 5 0,400 atm dan PNO 5 0,270 atm.
Contoh 14.4
Metanol (CH3OH) diproduksi secara industri oleh reaksi
CO(g) + 2H2(g) ↔ CH3OH(g)
Konstanta kesetimbangan (Kc) untuk reaksi adalah 10,5 pada 220 °C. Berapa nilai KP pada suhu ini?
Strategi Hubungan antara Kc dan KP diberikan oleh Persamaan (14,5). Apakah yang perubahan dalam jumlah mol gas dari reaktan ke produk? Ingat itu
∆n = mol produk gas - mol reaktan gas
Berapa satuan suhu yang harus kita gunakan?
Solusi Hubungan antara Kc dan KP adalah
Kp = Kc (0,0821 T)∆n
Karena T = 273 + 220 = 493 K dan ∆n = 1 - 3 = - 2, kita punya
Kp = (10,5) (0,0821 x 493)-2
= 6,41 x 10-3
Periksa Perhatikan bahwa KP, seperti Kc, adalah kuantitas tanpa dimensi. Contoh ini menunjukkan itu kita bisa mendapatkan nilai yang sangat berbeda untuk konstanta kesetimbangan untuk reaksi yang sama, tergantung pada apakah kita mengekspresikan konsentrasi dalam mol per liter atau di atmosfer.
Latihan untuk reaksi
N2(g) + 3H2 (g) ↔ 2NH3 (g)
Kp adalah 4,3 x 10-4 pada 375oC. Hitung harga Kc untuk reaksi
Kesetimbangan heterogen
Seperti yang Anda harapkan, hasil ekuilibrium heterogen dari reaksi reversibel melibatkan reaktan dan produk yang berada dalam fase yang berbeda. Misalnya, kapan kalsium karbonat dipanaskan dalam bejana tertutup, kesetimbangan berikut tercapai:
CaCO3 (s) ↔ CaO (s) + CO2 (g)
Kalsit mineral terbuat dari kalsium karbonat, seperti kapur dan marmer.
Dua padatan dan satu gas membentuk tiga fasa terpisah. Pada kesetimbangan, kita mungkin tuliskan konstanta kesetimbangan sebagai
(Sekali lagi, prima untuk Kc di sini adalah untuk membedakannya dari bentuk akhir dari ekuilibrium konstan akan diturunkan segera.) Namun, "konsentrasi" yang padat, seperti densitasnya, adalah properti intensif dan tidak tergantung pada seberapa banyak substansi itu menyajikan. Misalnya, "konsentrasi molar" tembaga (densitas: 8,96 g / cm3) pada 20 °C sama, apakah kita memiliki 1 gram atau 1 ton logam:
Untuk alasan ini, istilah [CaCO3] dan [CaO] sendiri adalah konstanta dan bisa dikombinasikan dengan konstanta kesetimbangan. Kita dapat menyederhanakan Persamaan (14.6) dengan menulis
di mana Kc, konstanta kesetimbangan "baru", diekspresikan dengan mudah dalam bentuk konsentrasi tunggal, yaitu CO2. Perhatikan bahwa nilai Kc tidak tergantung pada caranya CaCO3 dan CaO banyak yang hadir, selama beberapa dari masing-masing hadir di ekuilibrium (Gambar 14.4).
Situasi menjadi lebih sederhana jika kita mengganti konsentrasi dengan aktivitas. Dalam termodinamika, aktivitas padatan murni adalah 1. Jadi, istilah konsentrasi untuk CaCO3 dan CaO keduanya adalah kesatuan, dan dari persamaan ekuilibrium sebelumnya, kita bisa segera tuliskan Kc = [CO2]. Demikian pula, aktivitas cairan murni juga 1. Jadi, jika a reaktan atau produk adalah cairan, kita dapat menghilangkannya dalam ekspresi konstanta kesetimbangan.
Gambar 14.4 Dalam (a) dan (b) tekanan ekuilibrium CO2 adalah sama pada suhu yang sama, meski kehadirannya berbeda jumlah CaCO3 dan CaO.
Alternatifnya, kita dapat menyatakan konstanta kesetimbangan sebagai Kp = PCO2 
Konstanta kesetimbangan dalam hal ini secara numerik sama dengan tekanan gas CO2, kuantitas yang mudah diukur.
Contoh 14.5
Tuliskan persamaan konstanta kesetimbangan Kc dan Kp jika berlaku, untuk masing-masing mengikuti sistem heterogen
(a) (NH4)2Se(s) ↔ 2NH3 (g) + H2Se(g)
(b) AgCl(s) ↔ Ag+ (aq) + Cl-(aq)
(c) P4 (s) + 6Cl2 (g) ↔ 4PCl3(l)
Strategi Kami menghilangkan padatan murni atau cairan murni dalam konstanta kesetimbangan berekspresi karena kegiatan mereka adalah satu kesatuan.
Solusi
(a) Karena (NH4)2Se adalah padat, konstanta kesetimbangan Kc diberikan oleh
Sebagai alternatif, kita dapat mengekspresikan konstanta kesetimbangan Kp dalam hal parsial tekanan NH3 dan H2Se:
(b) Di sini AgCl adalah padat sehingga konstanta kesetimbangan diberikan oleh
Karena tidak ada gas, tidak ada ekspresi Kp.
(c) Kami mencatat bahwa P4 adalah solid dan PCl3 adalah cairan, sehingga mereka tidak muncul di ekuilibrium ekspresi konstan. Jadi, Kc diberikan oleh
Sebagai alternatif, kita dapat mengekspresikan konstanta kesetimbangan dalam hal tekanan dari Cl2:
Latihan Praktik Tulis ekpresi kesetimbangan konstan untuk Kc dan Kp untuk pembentukan tetracarbonyl nikel, yang digunakan untuk memisahkan nikel dari lain kotorannya:
CONTOH 14.6
Pertimbangkan keseimbangan heterogen berikut:
Pada 800°C, tekanan CO2 adalah 0,236 atm. Hitung (a) Kp dan (b) Kc untuk reaksi pada suhu ini.
Strategi Ingat bahwa padatan murni tidak muncul dalam konstanta kesetimbangan ekspresi. Hubungan antara Kp dan Kc diberikan oleh Persamaan (14.5).
Solusi (a) Menggunakan Persamaan (14.8) kita menulis
(b) Dari Persamaan (14,5), kami tahu
Kp = Kc (0,0821 T)∆n
Dalam hal ini, T = 800 + 273 = 1073 K dan ∆n = 1, jadi kami mengganti nilai-nilai ini dalam persamaan dan dapatkan
Latihan Pertimbangkan keseimbangan berikut pada 395 K:
NH4HS(s) ↔ NH3(g) + H2S(g)
Tekanan parsial setiap gas adalah 0,265 atm. Hitung Kp dan Kc untuk reaksi.
Review Konsep
Yang mana dari reaksi berikut adalah Kc sama dengan Kp?
(a) 4NH3 (g) + 5O2 (g) ↔ 4NO(g) + 6H2O(g)
(b) 2H2O2 (aq) ↔ 2H2O(l) + O2(g)
(c) PCl3(g) + 3NH3 (g) ↔ 3HCl(g) + P(NH2)3 (g)
Beberapa Equilibria
Reaksi yang kita anggap sejauh ini relatif sederhana. Lebih rumit situasi adalah satu di mana molekul-molekul produk dalam satu sistem kesetimbangan terlibat dalam proses ekuilibrium kedua:
A + B ↔ C + D
C + D ↔ E + F
Produk yang terbentuk dalam reaksi pertama, C dan D, bereaksi lebih jauh untuk membentuk produk E dan F. Pada kesetimbangan kita dapat menulis dua konstanta kesetimbangan terpisah:
Reaksi keseluruhan diberikan oleh penjumlahan dari dua reaksi
Reaksi keselurahan : 
dan konstanta kesetimbangan Kc untuk keseluruhan reaksi
Kami mendapatkan ekspresi yang sama jika kami mengambil produk dari ekspresi untuk K’c dan K”c:
Karena itu,
Kita sekarang dapat membuat pernyataan penting tentang beberapa kesetimbangan: Jika suatu reaksi dapat terjadi dinyatakan sebagai jumlah dari dua atau lebih reaksi, konstanta kesetimbangan untuk keseluruhan reaksi diberikan oleh produk dari konstanta kesetimbangan dari reaksi individu.
Di antara banyak contoh yang dikenal dari beberapa kesetimbangan adalah ionisasi asam diprotik dalam larutan encer. Konstanta kesetimbangan berikut telah ditentukan untuk asam karbonat (H2CO3) pada 25 ° C:
Reaksi keseluruhan adalah penjumlahan dari dua reaksi ini
dan konstanta kesetimbangan yang sesuai diberikan oleh
Menggunakan Persamaan (14,9) kami dapatkan
Review Konsep
Anda diberi konstanta kesetimbangan untuk reaksi
N2 (g) + O2(g) ↔ 2NO(g)
Misalkan Anda ingin menghitung konstanta kesetimbangan untuk reaksi
N2 (g) + 2O2(g) ↔ 2NO2(g)
Apa nilai konstanta kesetimbangan tambahan (untuk reaksi lain) yang Anda butuhkan untuk perhitungan ini? Asumsikan semua kesetimbangan dipelajari pada suhu yang sama.
Bentuk K dan Persamaan Ekuilibrium
Sebelum mengakhiri bagian ini, mari kita lihat dua aturan penting untuk menulis ekuilibrium konstanta:
Ketika persamaan untuk reaksi reversibel ditulis dalam arah yang berlawanan, konstanta kesetimbangan menjadi kebalikan dari konstanta kesetimbangan asli. Jadi, jika kita menulis kesetimbangan NO2 – N2O4 sebagai
N2O4 (g) ↔ 2NO2 (g)
kemudian pada 25 ° C,
Namun, kita dapat mewakili keseimbangan sama baiknya dengan
2NO2 (g) ↔ N2O4 (g)
dan konstanta kesetimbangan sekarang diberikan oleh
Anda dapat melihat bahwa Kc = 1 / K’c atau KcK’c = 1.00. Baik Kc atau K’c adalah kesetimbangan yang valid konstan, tetapi tidak ada artinya untuk mengatakan bahwa konstanta kesetimbangan untuk Sistem NO2-N2O4 adalah 4,63 x 10-3 , atau 216, kecuali kita juga menentukan bagaimana ekuilibrium Persamaan ditulis.
Nilai K juga tergantung pada bagaimana persamaan kesetimbangan seimbang. Mempertimbangkan cara-cara berikut menggambarkan kesetimbangan yang sama:
Melihat eksponen kita melihat bahwa K’c = (Kc)1/2 . Pada Tabel 14.1 kami menemukan Kc = 4.63 x 10-3 ; oleh karena itu K’c = 0,0680.
Menurut hukum aksi massa, masing-masing istilah konsentrasi dalam ekuilibrium ekspresi konstan dinaikkan ke kekuatan yang sama dengan koefisien stoikiometrinya. Jadi, jika Anda menggandakan persamaan kimia sepanjang, yang sesuai konstanta kesetimbangan akan menjadi kuadrat dari nilai aslinya; jika Anda tiga kali lipat persamaan, konstanta kesetimbangan akan menjadi kubus dari nilai asli, dan sebagainya di contoh NO2 – N2O4 menggambarkan sekali lagi kebutuhan untuk menulis bahan kimia persamaan saat mengutip nilai numerik dari konstanta kesetimbangan.
Contoh 14.7 berkaitan dengan hubungan antara konstanta kesetimbangan untuk persamaan seimbang yang berbeda menggambarkan reaksi yang sama.
Contoh 14.7
Reaksi untuk produksi amonia dapat ditulis dalam beberapa cara:
Tuliskan ekspresi konstanta kesetimbangan untuk setiap formulasi. (Ekspresikan konsentrasinya dari spesies yang bereaksi dalam mol/L.)
(d) Bagaimana konstanta kesetimbangan terkait satu sama lain?
Strategi Kami diberi tiga ekspresi yang berbeda untuk sistem reaksi yang sama. Ingat bahwa ekspresi konstanta kesetimbangan bergantung pada bagaimana persamaannya seimbang, yaitu, pada koefisien stoikiometri yang digunakan dalam persamaan.
Solusi
Latihan Tuliskan ekspresi ekuilibrium (Kc) untuk masing-masing hal berikut reaksi dan menunjukkan bagaimana mereka terkait satu sama lain: (a) 3O2 (g) ↔ 2O3 (g), (b) O2 (g) ↔ 2/3 O3 (g) .
Review Konsep
Dari ekspresi konstan ekuilibrium berikut, tuliskan bahan kimia yang seimbang persamaan untuk reaksi fase gas.

Ringkasan Pedoman untuk Menulis Ekuilibrium Ekspresi Konstan
1. Konsentrasi spesies yang bereaksi dalam fase kental diekspresikan dalam mol / L; dalam fasa gas, konsentrasi dapat dinyatakan dalam mol / L atau dalam atm. Kc terkait dengan KP dengan persamaan sederhana [Persamaan (14,5)].
2. Konsentrasi padatan murni, cairan murni (dalam kesetimbangan heterogen), dan pelarut (dalam kesetimbangan homogen) tidak muncul dalam konstanta kesetimbangan ekspresi.
3. Konstanta kesetimbangan (Kc atau Kp) adalah kuantitas tanpa dimensi.
4. Dalam mengutip nilai untuk konstanta kesetimbangan, kita harus menentukan yang seimbang persamaan dan suhu.
5. Jika reaksi dapat dinyatakan sebagai jumlah dari dua atau lebih reaksi, kesetimbangan konstan untuk reaksi keseluruhan diberikan oleh produk dari kesetimbangan konstanta dari reaksi individu.
1. Subchapter 14.3
Hubungan Antar Kimia
Kinetika dan Ekuilibrium Kimia
Untuk reaksi reversibel pada
kesetimbangan dan suhu konstan, rasio tertentu dari konsentrasi produk dan
reaktan memiliki nilai
konstan yaitu K
(konstanta kesetimbangan).
Kita telah melihat
bahwa K yang telah didefinisikan pada persamaan 14.2 adalah konstanta
pada suhu tertentu terlepas dari variasi dalam konsentrasi kesetimbangan suatu
spesi kimia. Kita dapat mengetahui mengapa hal tersebut bisa terjadi dan pada
waktu yang sama kita akan mendapatkan wawasan mengenai proses kesetimbangan
dengan mempertimbangkan kinetika reaksi kimia yang terjadi.
Mari kita anggap bahwa reaksi reversible berikut terjadi melalui mekanisme yang
terdiri dari langkah dasar dikedua arah reaksi maju dan reaksi balik:
Laju reaksi maju dituliskan sebagai
Vf = kf [A] [B]2
Dan laju reaksi balik dituliskan sebagai
Vr = kr [AB2]
Dimana kf dan kr adalah
konstanta laju untuk reaksi arah maju dan arah balik. Pada kesetimbangan,
ketika tidak ada perubahan bersih yang terjadi, kedua laju akan setara.
Karena kf dan kr adalah
konstanta laju pada suhu tertentu, maka rasionya adalah konstanta, yang sama
dengan konstanta kesetimbangan Kc.
Jadi, Kc akan
selalu konstanta terlepas dari konsentrasi kesetimbangan dari spesi yang
bereaksi karena akan selalu sama dengan kf/kr, hasil
bagi dari dua konstanta
laju tahap reaksi pada suhu tertentu. Karena konstanta laju bergantung pada suhu (persamaan 13.11),
maka konstanta kesetimbangan juga akan berubah bersama dengan suhu.
Nilai konstanta
laju menurun dengan meningkatnya energi aktivasi dan meningkat dengan
meningkatnya suhu.
Sekarang anggaplah suatu reaksi yang sama memiliki mekanisme lebih dari satu
langkah dasar. Anggap
itu terjadi melalui mekanisme dua langkah sebagai berikut:
Ini adalah contoh dari
beberapa kesetimbangan, yang dibahas dalam Bagian 14.2. Dapat digambarkan
sebagai berikut:
Perkalian
Persamaan (14.10) oleh Persamaan (14.11), kita dapatkan
Karena
keduanya K’ dan K’’ adalah konstanta, Kc juga
merupakan konstanta. Hal ini memungkinkan
adanya generalisasi pada reaksi:
Terlepas
dari apakah reaksi ini terjadi melalui mekanisme satu langkah atau lebih, kita dapat menuliskan kontanta kesetimbangan sesuai
dengan hukum aksi massa ditampilkan dalam Persamaan (14.2):
Singkatnya,
kita melihat bahwa dalam hal kinetika kimia, konstanta kesetimbangan suatu
reaksi dapat dinyatakan sebagai rasio dari konstanta laju reaksi maju dan reaksi balik. Analisis ini menjelaskan mengapa
konstanta kesetimbangan adalah konstan dan mengapa nilainya berubah bersamaan dengan suhu
4. PERCOBAAN
-
5. VIDIO
6. LINK DOWNLOAD
KLIK DISINI






















Tidak ada komentar:
Posting Komentar