LATIHAN DAN KUIS 5
LATIHAN
1. 2 mol PCl5 dimasukkan ke dalam wadah 2 L dan dipanasi pada suhu 250 °C untuk mencapai keadaan setimbang, ketika 60% PCl5 terurai menjadai PCl3 dan Cl2. Nilai tetapan kesetimbangan, Kc, untuk reaksi PCl5 (g) ⇌ PCl3 (g)
2. Suatu sistem reaksi dalam keadaan setimbang bila…
a. Reaksi berlangsung dua arah pada waktu bersamaan
b. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
c. Jumlah mol zat yang ada pada keadaan setimbang selalu sama
d. Masing-masing zat yang bereaksi sudah habis
e. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi
Pembahasan:
Kesetimbangan dinamis yaitu proses bolak-balik dengan laju yang sama untuk kedua arah. Proses kesetimbangan dinamis ini dapat terjadi pula dalam suatu reaksi kimia.
Jawaban : B
3. Rumusan tetapan kesetimbangan untuk reaksi :

Pembahasan :
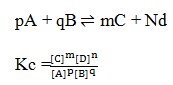
Hukum kesetimbangan yaitu bila suatu reaksi dalam keadaan setimbang, mak hasil kali konsentrasi zat-zat hasil reaksi dipangkatkan koefisiennya dibagi dengan hasil kali konsentrasi zat-zat pereaksi dipangkatkan koefisiennya akan mempunyai harga tetap. Jika reaksi itu dalam wujud solid dan liquid maka diabaikan.
Jawaban : E
Gas N2O5 terurai menurut kesetimbangan berikut.
![]()
Dalam wadah 1 L dimasukkan 0,25 mol gas N2O5. Saat kesetimbangan tercapai, terdapat 0,1 mol NO2. Tetapan keseimbangan Kc, untuk reaksi tersebut adalah…
- 1,11 x 10-4
- 6,25 x 10-3
- 6,25 x 10-5
- 6,67 x 10-6
- 4,25 x 10-5
Diketahui:
Persamaan reaksi kesetimbangan penguraian gas N2O5:
![]()
Volume wadah = 1 L
Mol gas N2O5 = 0,25 mol
Mol NO2 pada sat keseimbangan = 0,1 mol
Ditanya:
Tetapan kesetimbangan (Kc) = …?
Pembahasan:
Persamaan stoikiometri untuk reaksi kesetimbangan penguraian gas N2O5:
Oleh karena volume wadah adalah 1 L, maka molaritas senyawa sama dengan mol senyawa.
M=n/V, dengan n = mol



Tidak ada komentar:
Posting Komentar