LATIHAN DAN KUIS 9
LATIHAN
Dalam ruangan 1 liter terdapat kesetimbangan antara gas N2, H2 dan NH3 sesuai persamaan reaksi berikut.
![]()
Pada kesetimbangan tersebut terdapat 0,01 mol N2, 0,01 mol H2 dan 0,05 mol NH3. Nilai tetapan kesetimbangan reaksi adalah…
a. 2 x 10-8
b. 4 x 10-6
c. 5 x 10-10
d. 2 x 10-10
e. 2 x 10-10
(Advanced Learning Chemistry 2A, Nana Sutresna, Facil, 2010, h 185)
Pembahasan :
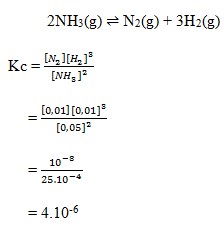
Jawaban : B
Perhatikan reaksi berikut.
A + B → C + D
Jika satu mol A dicampur dengan satu mol B dan pada kestimbangan terdapat 0,2 mol A, tetapan kesetimbangan reaksi diatas adalah…
a. 0,4
b. 1,6
c. 4
d. 8
e. 16
Pembahasan :

Jawaban : E
Pada suhu 750 K terdapat kesetimbangan :
![]()
Jika R = 0,08 harga Kp adalah…
a. 1,5 x 10-1
b. 1,6 x 10-2
c. 2,7 x 10-3
d. 7,5 x 10-4
e. 1,25 x 10-5
(OSN Kimia SMA, A. Haris Watoni, Yramawidya, 2014, h 224)
Pembahasan :
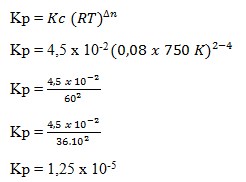
Jawaban : E
KUIS
Pada suhu 700 K terjadi reaksi kesetimbangan :
![]()
Nilai Kp untuk reaksi tersebut adalah…
a. 0,99
b. 9,99
c. 0,11
d. 11,0
e. 110
(OSN Kimia SMA, A. Haris Watoni, Yramawidya, 2014, h 225)

Jawaban : C
Tetapan kesetimbangan untuk reaksi kesetimbangan :
2A(g) + B(g) ↔ C(g) + D(g)
Pada suhu tertentu adalah 2,5. Bila reaksi ke arah C dan D adalah eksotermik, maka bila suhu dinaikkan, tetapan kesetimbangan menjadi . . . .
a. Tetap 2,5
b. Kurang dari 2,5
c. Lebih dari 2,5
d. Tidak tentu
e. Tidak dapat diprediksi
(OSN Kimia SMA, A. Haris Watoni, Yramawidya, 2014, h 224)
Pembahasan :
Sesuai dengan azas Le Chatelier “ jika suhu dinaikkan maka reaksi akan bergeser kearah reaksi yang menyerap kalor (reaksi endoterm). Jika suhu diturunkan maka reaksi bergeser kearah reaksi yang melepas kalor (reaksi endoterm)”
“ suhu berubah, maka nilai Kc berubah” dimana bila reaksi bergeser kekanan maka nilai Kc makin besar dan jika reaksi bergeser kekiri maka nilai Kc makin kecil
Jawaban : B
Pada peruraian 1 mol gas SO3 menjadi gas SO2 dan O2 dalam ruang bervolume 5 dm³ diperoleh gas O2 sebanyak 0,25 mol, maka harga tetapan kesetimbangan sebesar. . . . M
Pembahasan :
Diket : V = 5 dm³ = 5 L
SO3 = 1 mol
O2 = 0,25 mol
Dit : Kc
Penyelesaian
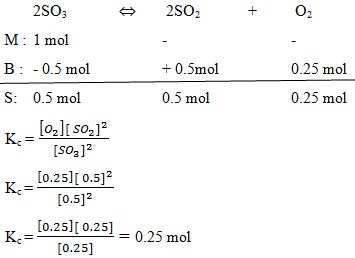
n = M. V
0.25 mol = M . 5 L
M = 0.25 mol/ 5 L
M = 0.05 M


Tidak ada komentar:
Posting Komentar